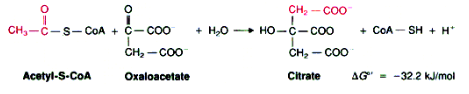Ciclo de Krebs
El ciclo de Krebs es una serie de reacciones químicas de gran importancia, que forma parte de la respiración celular en todas las células aerobias, es decir, que utilizan oxígeno como aceptor final de electrones. En organismos aeróbicos es parte de la vida catabólica que realiza la oxidación de hidratos de carbono, ácidos grasos y aminoácidos hasta producir CO2 y agua, liberando energía en forma utilizable. El ciclo de Krebs también proporciona precursores para muchas biomoléculas, tales como ciertos aminoácidos. Por ello se considera una vía anfibólica, es decir, catabólica y anabólica al mismo tiempo. El descubrimiento y unificación del metabolismo fue hecho en 1937 por Sir Han Krebs y W.A. Johnson, ellos mostraron que el citrato derivado del piruvato y del oxalacetato completando lo que se conoce como el ciclo del ácido cítrico. (Gutiérrez, 2011).
El ciclo de Krebs, o ciclo del ácido cítrico, genera la mayor parte de los acarreadores de electrones (energía) que se conectarán en la cadena transportadora de electrones (CTE) en la última parte de la respiración celular. También se le conoce como el ciclo del ácido cítrico o ciclo de los ácidos tricarboxílicos, esto se debe porque es una cadena de oxidación, reducción y transformación del citrato. El citrato o ácido cítrico es una estructura de seis carbonos que completa el ciclo regenerándose en oxalacetato. El oxalacetato es la molécula necesaria para producir nuevamente ácido cítrico. El ciclo de Krebs solo es posible gracias a la molécula de glucosa, la glucosa, mediante la glucólisis, generará los dos piruvatos que producirán, en lo que se considera como la fase preparatoria del ciclo de Krebs, acetil-CoA, necesaria para obtener citrato o ácido cítrico. (Anónimo, 2013).
En bacterias, las reacciones del ciclo de Krebs acontecen en el citoplasma y en la membrana citoplásmica. Este ciclo necesita de catálisis enzimáticas para funcionar, o sea, necesita la ayuda de enzimas para que las moléculas puedan reaccionar entre sí y se considera un ciclo porque existe una reutilización de las moléculas. (Gutiérrez, 2011)
Reacciones del ciclo de Krebs
1) FORMACIÓN DEL CITRATO
La primera reacción del Ciclo de Krebs está catalizada por la enzima citrato sintasa, que producirá citrato sin la necesidad de ATP. Es una reacción parecida a la condensación aldólica, donde tenemos como reactivos al oxalacetato y al acetil-CoA. Esta es una reacción exergónica e irreversible (-32.2 kJ/mol). (Crespo, 2017) (Figura 3)
La reacción contraria es catalizada por la enzima citrato liasa.
El carbono metílico del grupo acetilo de la acetil-CoA va a perder un protón por efecto de un residuo de histidina de la citrato sintasa. Esto dará paso a la formación a un carboanión que realizará un ataque nucleofílico al carbono carbonílico del oxalacetato, dando como resultado citroil-CoA, compuesto muy inestable. Se dará la hidrólisis espontánea del compuesto gracias a la entrada de una molécula de agua, liberándose con esto el citrato y acil-CoA en su forma reducida. (Crespo, 2017) (Figura 4)
2) FORMACIÓN DEL ISOCITRATO
La segunda reacción del ciclo de Krebs consta de dos reacciones que ocurren de manera continua y que están catalizadas por la enzima aconitasa. Es una reacción reversible. Es una reacción de isomerización donde cambiará la posición del OH. (http://proteinasestructurafuncion.usal.es/moleculas/Aconitasa/index.html) (Figura 6)
3) FORMACIÓN DE α-CETOGLUTARATO
La tercera reacción del ciclo de Krebs, al igual que en el anterior paso, está conformada por dos reacciones simultaneas catalizadas por la misma enzima: isocitrato deshidrogenasa:
a) Oxidación del Isocitrato: Al ser una reacción de oxidación se va dar la perdida de hidrógenos, uno en forma de protón y otro en forma de hidruro. Al quitarse hidrógenos se necesita de una molécula que los acepte, aquí es donde entra NAD+ (su forma oxidada) que va a pasar a reducirse. Siendo en esta reacción donde se produce el primer NADH. (https://es.slideshare.net/coaticle/ciclo-de-krebs-isocitrato-isocitratodeshidrogenasa) (Figura 7)
El grupo -OH del Isocitrato (en el C-2) se va a oxidar hasta carbonilo, con la correspondiente perdida de dos átomos de carbono, que son recibidos por la coenzima NAD+ (reduciéndose hasta NADH + H+ ). Dándose la formación de oxalosuccinato, molécula estabilizada por Mn+2 o Mg+2 que no se disocia de la enzima. (https://es.slideshare.net/coaticle/ciclo-de-krebs-isocitrato-isocitratodeshidrogenasa)
b) Descarboxilación de oxalosuccinato: Debido a la reacción anterior, el enlace del grupo carbonilo central se ve debilitado, y la molécula lo pierde en forma de una molécula de CO2, dándose la descarboxilación. Se da la formación del doble enlace entre C2-C3 formando un intermediario. Se introduce uno de los H+ que fueron liberados en la reacción anterior en el C3, produciendo la eliminación del doble enlace para dar paso a la formación del carbonilo en el carbono 2. Siendo este el alfa-cetoglutarato. (http://proteinasestructurafuncion.usal.es/moleculas/IsocitratoDeshidrogenasas/index.html) (Figura 7)
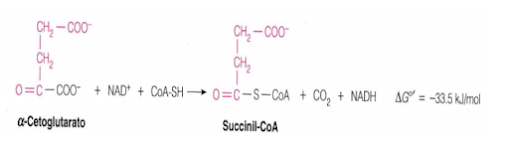
Este paso es similar al tercero, puesto que ocurre la segunda descarboxilación oxidativa. En este caso, es el α-cetoglutarato que se oxida, lo que reduce un NAD+ en NADH + H+ y en el proceso libera una molécula de CO2. La molécula de 4 carbonos resultante se une a la coenzima A y forma el compuesto succinil CoA. La enzima que cataliza este paso, α-cetoglutarato deshidrogenasa, también es importante en la regulación del ciclo del ácido cítrico. (https://bioquibi.webs.ull.es/metabolismo/antonio/ciclo%20de%20krebs.pdf) (Figura 8)
Al igual que el complejo piruvato deshidrogenasa, el complejo α-cetoglutarato deshidrogenasa es un complejo multienzimático, consta de las siguientes enzimas: α-cetoglutarato deshidrogenasa (E1), dihidrolipoil transsuccinilasa (E2) y dihidrolipoil deshidrogenasa (E3). E intervienen las 5 coenzimas: pirofosfato de tiamina, ácido lipoico, coenzima A reducida, FAD y NAD+. (https://bioquibi.webs.ull.es/metabolismo/antonio/ciclo%20de%20krebs.pdf)
La dihidrolipoil deshidrogenasa (E3) es la enzima terminal en los complejos de piruvato y α-cetoglutarato deshidrogenasa. En ambos de estos complejos, E3 cataliza la reacción:
Lip(SH)2 + NAD+ -----> LipS2 + NADH + H+
Esta reacción oxida al ácido lipoico que es la fracción catalítica de la dihidrolipoil transsuccinilasa (E2). El complejo α-cetoglutarato deshidrogenasa elimina una molécula de CO2 del α-cetoglutarato en la primera enzima, α-cetoglutarato deshidrogenasa (E1). Primero reacciona el anillo tiazólico del pirofosfato de tiamina (PPT), el carbono del grupo tiazolio está en forma de carbanión, el cual va a atacar al carbono carbonílico del α-cetoglutarato mediante una transposición de un par electrónico. El carbono carbonílico produce el desplazamiento de un par electrónico de un enlace hacia el oxígeno haciéndolo muy electronegativo con seis electrones alrededor de él, y un carbono deficiente de electrones por tener únicamente tres enlaces. El carbanión del tiazolio viene y ataca al carbono, se pega el carbono carbonílico del α-cetoglutarato al PPT. (https://bioquibi.webs.ull.es/metabolismo/antonio/ciclo%20de%20krebs.pdf)
Luego, E2 reemplaza el CO2 extraído con un grupo CoA que produce succinil-CoA. Finalmente, dihidrolipoil deshidrogenasa (E3) toma como sustrato el ácido lipoico, le quita los hidrógenos y se los pasa al NAD+, formando así NADH + H+ quedando el ácido lipoico oxidado. (https://bioquibi.webs.ull.es/metabolismo/antonio/ciclo%20de%20krebs.pdf)
La CoA de la succinil CoA se sustituye con un grupo fosfato que luego es transferido a ADP para obtener ATP. En algunas células se utiliza GDP (guanosín difosfato) en lugar de ADP, con lo que se obtiene GTP (guanosín trifosfato) como producto. La molécula de 4 carbonos producida en este paso se llama succinato.(https://bioquibi.webs.ull.es/metabolismo/antonio/ciclo%20de%20krebs.pdf) (Figura 9)
Para el mecanismo de reacción tenemos:
a) Formación del succinil fosfato, un anhídrido mixto de "alta energía".
La reacción se va a iniciar entre el fosfato y el succinato en una reacción de sustitución nucleofílica del acilo. Se sustituye el acilo desplazando a la Coenzima A. El azufre es un elemento muy electronegativo, por lo tanto tratará de mantener su par electrónico, es decir, el enlace entre azufre y carbono. Se rompe el carbonilo, se queda sin el enlace, de tal manera que el par electrónico lo mantiene el azufre para seguir siendo electronegativo. El carbono carbonilo queda con 3 enlaces, adquiere una delta (+). El oxígeno del grupo fosforilo que tiene 3 pares electrónicos libres va a atacar al carbono (le va a donar 1 par electrónico) y de esta manera se forma la molécula succinil fosfato. El azufre "arranca" el hidrógeno del grupo fosforilo y tenemos la forma reducida de la coenzima A. (https://bioquibi.webs.ull.es/metabolismo/antonio/ciclo%20de%20krebs.pdf) (Figura 10)
b) Formación de fosforil-His, un intermediario de "alta energía".
En una segunda sustitución nucleofílica, participa la Enzima-His, cuyo centro activo es el nitrógeno, que al igual que el oxígeno y el azufre, es muy electronegativo, trabaja con un par electrónico libre, en este caso dejará parcialmente con un carga positiva al fosfato de tal manera que el carbono carbonilo se queda con el oxígeno, puesto que se rompe el enlace P-O, y éste oxígeno mantiene el par electrónico para la formación del anhídrido carbónico. Entonces, la reacción decanta hacia la formación de un anhídrido de tal manera que el fósforo pierde el enlace y el nitrógeno lo estabiliza con su par electrónico libre. El segundo nitrógeno de la Enzima-His recupera el par electrónico a través de la liberación de un hidrógeno, se desprende y el enlace N-H pasa a formar una doble ligadura dentro del anillo, y al introducirse el doble enlace entre carbono-nitrógeno, el centro activo vuelve a recuperar su par electrónico libre. De esta manera se da la formación de 3-Fosfo-His más el anhídrido carbónico, el cual es Succinato. (https://bioquibi.webs.ull.es/metabolismo/antonio/ciclo%20de%20krebs.pdf) (Figura 10)
c) Transferencia del grupo fosforilo al GDP, formándose GTP.
El residuo de 3-Fosfo-His resultante transfiere su fosfato al sustrato nucleósido difosfato, que puede ser ADP o GDP en una reacción de sustitución nucleofílica final. En este caso, el nitrógeno le quita su par electrónico al fósforo y éste adquiere una carga delta (+), viene el GDP (que en bacterias sería ADP), donde el oxígeno le va a donar un par electrónico y lo va a unir, de tal manera que se forma el GTP (puede ser ATP). Por otro lado, el enlace mueve su par electrónico libre hacia N-C haciendo resonancia, el segundo nitrógeno adquiere un par electrónico libre que va a ser capaz de "atrapar" el protón que va entrando y así se regenera nuevamente la His en su conformación original. (https://bioquibi.webs.ull.es/metabolismo/antonio/ciclo%20de%20krebs.pdf) (Figura 10)
6) FORMACIÓN DE FUMARATO
La enzima succinato deshidrogenasa oxida succinato a fumarato (oxidación dependiente de flavina) formando FADH2. A diferencia de las demás enzimas del ciclo de Krebs, que se encuentran en forma de proteínas solubles en la matriz mitocondrial, la succinato deshidrogenasa está fijada a la membrana mitocondrial interna (en eucariotas), donde actúa de nexo entre el ciclo de Krebs y la fosforilación oxidativa. Realmente la reacción dada es sólo una reacción parcial de las 2 subunidades hidrofílicas del complejo II de la cadena respiratoria, que introduce electrones del FADH2 procedentes de la oxidación del succinato en la fosforilación oxidativa (Müller, 2008).
La enzima es fuertemente inhibida por malonato, análogo estructural del
succinato.
Compuestos formados por cada Vuelta
 |
| Tabla 1. Productos formados durante el ciclo de Krebs. |
El ciclo del ácido cítrico está regulado principalmente por la concentración de ATP y NADH. Los puntos de control clave son las enzimas alóstericas isocitrato deshidrogenasa y α-cetoglutarato deshidrogenasa. la ausencia de piruvato detiene el ciclo al no poder obtenerse acetil-CoA. (Berg y cols., 2002).
La regulación del ciclo del ácido cítrico es importante ya que las reacciones que no se controlan darán lugar a grandes cantidades de energía metabólica desperdiciada. La capacidad de regular el ciclo mantiene a la célula en un estado estable y esta función se mantiene mediante los siguientes mecanismos:
Isocitrato deshidrogenasa estimulada por baja cantidad energética celular (ADP)
La enzima isocitrato deshidrogenasa se estimula alostéricamente por la presencia de ADP, que por consecuencia aumenta la afinidad de la enzima por el sustrato aumentando la producción de ATP. Las uniones de isocitrato, de NAD+, de Mg+2, y de ADP, a la enzima son mutuamente cooperativas en sentido activador. Por el contrario, el NADH inhibe la enzima por el desplazamiento directo de NAD+. El ATP inhibe los siguientes procesos del ciclo deteniendo la producción de más ATP. (Berg y cols., 2002)
Inhibición de α-cetoglutarato deshidrogenasa
Un segundo sitio de control en el ciclo del ácido cítrico es la α-cetoglutarato deshidrogenasa. Algunos aspectos del control de esta enzima son como los del complejo piruvato deshidrogenasa, como podría esperarse de la homología de las dos enzimas. La α-cetoglutarato deshidrogenasa es inhibida por succinil CoA y NADH, los productos de la reacción que cataliza. Además, La α-cetoglutarato deshidrogenasa puede ser también inhibida genéricamente por un alto nivel energético presente en la célula. Esto significa que, en presencia de altos niveles de ATP, la célula es capaz de reducir la eficiencia del proceso de producción de energía. (Berg y cols., 2002)
Calcio como regulador del ciclo del ácido cítrico
El calcio también es un importante regulador del ciclo del ácido cítrico; un aumento en las concentraciones tanto de ADP como de iones calcio es consecuencia de cambios en la actividad celular. Por tanto, la señal que estimula la contracción muscular también activa la producción del ATP que la sustenta, a través del ciclo del ácido cítrico. Los iones de calcio regulan el ciclo del ácido cítrico activando la piruvato deshidrogenasa, el primer componente de la reacción del complejo de piruvato deshidrogenasa que forma acetil-CoA. Los iones de calcio también activan las enzimas, isocitrato deshidrogenasa y α-cetoglutarato deshidrogenasa que catalizan el tercer y cuarto paso del ciclo, respectivamente. La activación de estas enzimas, a través de los iones de calcio, aumenta la velocidad de reacciones separadas dentro del ciclo y, por lo tanto, aumenta la producción de producto durante todo el ciclo. (Shelley Farrar Stoakes, 2019).
Regulación de velocidad del ciclo
El flujo de metabolitos a través del ciclo del ácido cítrico
puede estar limitado por la disponibilidad de sustratos:
- oxalacetato y acetil-CoA
- por niveles bajos de NAD+, que enlentecen los tres pasos
oxidativos en los que interviene como cofactor.
La velocidad de oxidación de fragmentos dicarbonados (acetil-CoA) por el ciclo también se reduce cuando la célula tiene una alta carga energética, es decir alta concentración de ATP, y cuando hay baja concentración o ausencia de O2 . (Berg y cols., 2002).
- ISOCITRATO DESHIDROGENASA. Obtenido el 8 de enero de 2021, de: http://proteinasestructurafuncion.usal.es/moleculas/IsocitratoDeshidrogenasas/index.html
- Ciclo de Krebs, isocitrato isocitrato deshidrogenasa. (2010). Obtenido el 8 de enero de 2021, de: https://es.slideshare.net/coaticle/ciclo-de-krebs-isocitrato-isocitratodeshidrogenasa
- Crespo. (2017). Mecanismo de reacción de la citrato sintasa. Obtenido el 8 de enero de 2021, de: https://docplayer.es/36674421-Mecanismo-de-reaccion-de-la-citrato-sintasa.html
- ACONITASA. Obtenido el 8 de enero de 2021, de: http://proteinasestructurafuncion.usal.es/moleculas/Aconitasa/index.html
- Complejo α-cetoglutarato deshidrogenasa. Obtenido el 11 de enero de 2021, de: https://bioquibi.webs.ull.es/metabolismo/antonio/ciclo%20de%20krebs.pdf
- Succinil-CoA sintetasa. Fosforilación a nivel de sustrato. Obtenido el 11 de enero de 2021, de: https://bioquibi.webs.ull.es/metabolismo/antonio/ciclo%20de%20krebs.pdf
-Anónimo. (2013). Significado del ciclo de Krebs. Obtenido el 12 de enero de 2021, de: https://www.significados.com/ciclo-de-krebs/
-Gutiérrez Yapú, G. (2011). Ciclo del Ácido Cítrico. Obtenido el 11 de enero de 2021, de Facultad de Ciencias Farmacéuticas y Bioquímicas Sitio web: http://fcfb.umsa.bo/c/document_library/get_file?uuid=9d8c65b2-dfc4-47ed-829b-4278cb7b14ff&groupId=207688011
- Müller, W. (2008). Bioquímica. Fundamentos para Medicina y Ciencias de la Vida. (pp. 499-504). Editorial Reverté. España.
- Voet, D. y Voet, J. (2006). Bioquímica. 3ra. edición. (pp. 797). Editorial Médica Panamericana. México.
- Berg, J., Tymoczko, J. y Stryer, L. (2008). Bioquímica. 6ta. edición. (pp.488). Editorial Reverté. México.
- Berg, J., Tymoczko, J., & Stryer, L. (2002). Entry to the Citric Acid Cycle and Metabolism Through It Are Controlled. Obtenido el 13 de enero de 2021, de https://www.ncbi.nlm.nih.gov/books/n/stryer/A2409
- Shelley Farrar Stoakes, B. (2019). Citric Acid Cycle Regulation. Obtenido el 13 enero de 2021, de https://www.news-medical.net/life-sciences/Citric-Acid-Cycle-Regulation.aspx