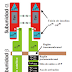
Los receptores de insulina (IR), son proteínas de membrana de tipo heterotetramérica, que se encuentra unida por enlaces disulfuros. Está conformada por dos subunidades subunidades alfa de tipo extracelular (que son las que se unen a la molécula de insulina por medio de las regiones de unión a insulina α1 y α2), unidas a dos subunidades beta por medio de enlaces disulfuro. Estas subunidades beta se encuentran embebidas en la membrana, con una porción extracelular, una transmembranal y una intracelular. En la parte intracelular podemos encontrar el dominio catalítico de tirosina quinasa, que contiene un sitio de unión de ATP y sitios de fosforilación de tirosina en lo que sería la región juxtamembranal, el asa de activación y el COOH-terminal. (Figura 1) (Bastarrachea y cols., 2005).
Vías de señalización de la insulina
Entonces, tras
darse la unión de la insulina con el receptor se dará el encendido de la cascada
de señalización, donde tenemos a dos vías principales de transducción: La vía
de señalización de la PI3K, que culmina con el favorecimiento de la activación
de la glucógeno sintasa y el aumento de la síntesis de glucógeno; de igual
manera, tras la activación de esta cascada se puede dar la regulación de la síntesis
proteica. Y la vía de señalización de MAP cinasas, culminando en la transcripción
de genes, así como en la regulación genética en tejidos sensibles a la
insulina, pero no así con la regulación del transporte de glucosa.
Transporte de glucosa
Utilizando una
vía dependiente de activación por PI3K y de cinasa Akt, la insulina promueve la
translocación de GLUT4 desde los compartimentos intracelulares a la membrana
plasmática, esto utilizando AS160 (que una proteína cuyo estado no fosforilado
va a regular de manera negativa la actividad de las proteínas G pequeñas Rab,
que tienen participación en el trafico vesicular de GLUT4, debido a que
inhiben la exocitosis basal de este transportador. (Figura 2)
Mecanismos de regulación de la señal de insulina
- Endocitosis y reciclamiento de los receptores: Donde se controla la degradación y la cantidad de estos en la membrana celular.
- Acción de proteínas con actividad de fosfatasa de tirosina (PTPs): Estás desfosforilan residuos de proteínas clave en la señalización de insulina, como lo serían los sustratos de receptor de insulina y el mismo receptor.
- Fosforilación en residuos de Ser/Thr del receptor de insulina y de sus sustratos. (Olivares y Arellano, 2008)
Resistencia a la insulina
En la resistencia a la insulina se puede observar una disminución en el
transporte de glucosa inducido por la insulina en el musculo esquelético y adipocitos,
así como un aumento en la producción de glucosa en hígado y alteraciones metabólicas
de lípidos en hepatocitos y adipocitos. Dada entonces por una deficiente señalización
de la insulina debida a mutaciones o modificaciones postraduccionales del receptor
de insulina.
Entre los agentes involucrados en esta patología, lo más comunes son los
ácidos grasos libres y sus metabolitos (TNF-α y algunas citocinas),
hormonas catabólicas como la epinefrina, glucagón y angiotensina II, así como
la resistina que es secretada en tejido adiposo. Por esto, la resistencia a la
insulina es considerada como una afección de múltiples inductores. Debido a
esto, se considera que el aumento en la concentración plasmática de ácidos
grasos libres está asociado con muchos de los estados de resistencia a la
insulina, como lo sería la obesidad y la diabetes mellitus tipo 2.
Este incremento de la concentración de ácidos grasos en el torrente sanguíneo induce a la resistencia a la insulina debido a que inhibe el transporte de glucosa mediado por insulina, que a su vez le sigue una reducción de la glucógeno síntesis en músculo y oxidación de la glucosa. Estos ácidos grasos pueden producir cambios en la expresión de los receptores, y con esto alterar la unión de la insulina o el estado de fosforilación del dominio de cinasa; también puede inhibir la activación de PI3K (que se asocia a un aumento en la fosforilación de los residuos Ser/Thr de los ISR). E, incluso, pueden alterar la activación de Akt. (Olivares y Arellano, 2008).






Muy buena información.
ResponderEliminarExcelente información
ResponderEliminar